莫德纳研发的mRNA-1273疫苗是美国首个进入人体试验阶段的疫苗,初步数据来自其中八名志愿者,结果显示部分健康志愿者在注射其疫苗后产生保护性抗体,给全球抗击冠病疫情的努力带来一线希望。
(华盛顿综合电)美国生物技术公司莫德纳(Moderna)的疫苗临床试验初步结果显示,部分健康志愿者在注射其疫苗后产生保护性抗体,即类似于冠病康复者的免疫反应,这给全球抗击冠病疫情的努力带来一线希望。
莫德纳研发的mRNA-1273疫苗是美国首个进入人体试验阶段的疫苗,此次的初步数据来自八名志愿者。
共有45名年龄在18岁至55岁的志愿者分成三组,在今年3月参与了第一阶段的试验。他们接受了三种不同剂量的疫苗,但完整结果尚未出炉。
不过,总体而言,试验显示疫苗是安全的,一些人的注射部位有疼痛和发红现象,有志愿者在第二次注射较高剂量的疫苗后出现“类似感冒”的症状,但莫德纳相信这是人体出现强烈免疫反应的间接结果。
值得注意的是,所有参与者都产生了针对冠状病毒的抗体。其中,接受100微克剂量和25微克剂量的人所产生的抗体水平,超过了冠病康复者血液中所发现的抗体水平。
莫德纳首席执行官班塞尔说,这一初步检验结果显示,其疫苗针对冠病“提供保护的可能性很大”“对于这些初步数据,我们再高兴不过了”。
美国约翰斯·霍普金斯卫生安全中心传染病专家阿达尔贾并未参与此次研究,他指出:“第一阶段临床试验是为安全而不是为疗效设计的。”
他认为,从现在到针对数以千计的人试验该疫苗的疗效之前,还可能出现许多问题,但“我们目前确实看到了令人鼓舞的情况”。
科学家还在确定,须产生多少抗体才能有效对抗冠状病毒,以及其疗效可以持续多久。莫德纳指出,初步试验结果显示,注射高剂量疫苗的人,所产生的抗体比注射低剂量者来得多。
美国当局已为莫德纳启动第二阶段的人体临床试验开启绿灯,莫德纳接下来将测试该疫苗的疗效,确认可发挥最大效用的剂量。
莫德纳表明,将在第二阶段测试50微克的剂量。该公司首席医疗官扎克斯说:“在疾病大流行期间,我们预计(疫苗)需求会大大超越供应,因此若可以使用越低的剂量,我们就能保护越多的人。”
至于第三阶段的更大规模临床试验,莫德纳预计会在7月展开。
伦敦大学卫生与热带医学院的药物流行病学教授埃文斯谨慎指出,虽然目前可看到莫德纳的疫苗或许能有效对抗冠病的乐观迹象,但“在第三阶段试验完成前,我们将无法知道这个疫苗是否真的能对抗冠状病毒”。

 国际特稿:白罗斯反击欧盟移民沦为棋子
国际特稿:白罗斯反击欧盟移民沦为棋子 美医学专家:“清零”策无法根除冠病
美医学专家:“清零”策无法根除冠病 韩国前总统“光州屠夫”全斗焕病逝
韩国前总统“光州屠夫”全斗焕病逝 专家:多国悄悄展开军备竞赛
专家:多国悄悄展开军备竞赛 七国集团吁采紧急行动对抗新病毒
七国集团吁采紧急行动对抗新病毒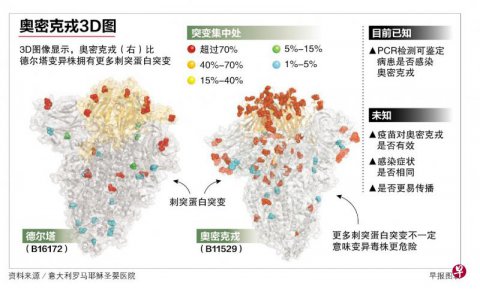 全球加紧研究奥密克戎 暂不能确定症状
全球加紧研究奥密克戎 暂不能确定症状 面临新毒株威胁 欧洲各国不敢掉以轻心
面临新毒株威胁 欧洲各国不敢掉以轻心 多国对南非实施入境限制 旅客涌向机场
多国对南非实施入境限制 旅客涌向机场